第一章 總則
第一條 依據(jù)《藥物臨床試驗(yàn)質(zhì)量管理規(guī)范》《涉及人的生物醫(yī)學(xué)研究倫理審查辦法2016》《藥物臨床試驗(yàn)倫理審查工作指導(dǎo)原則》《體外診斷試劑臨床試驗(yàn)技術(shù)指導(dǎo)原則2014》《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范2016》《涉及人的臨床研究倫理審查委員會(huì)建設(shè)指南》,杭州市第三人民醫(yī)院醫(yī)學(xué)倫理審查委員會(huì)制定《杭州市第三人民醫(yī)院倫理委員會(huì)章程》,。
第二章 機(jī)構(gòu)組成
第二條 杭州市第三人民醫(yī)院醫(yī)學(xué)倫理審查委員會(huì)需保證其有能力對申請項(xiàng)目的相關(guān)倫理問題進(jìn)行審查和評價(jià),,并保證在沒有偏移和影響其獨(dú)立性的情況下進(jìn)行工作。
第三條 醫(yī)學(xué)倫理審查委員會(huì)由生物醫(yī)學(xué)領(lǐng)域和倫理學(xué)、法學(xué)、社會(huì)學(xué)等領(lǐng)域的專家和非本機(jī)構(gòu)社會(huì)人士中遴選產(chǎn)生,組成人數(shù)不少于7人,。
第四條 醫(yī)學(xué)倫理審查委員會(huì)由男性或女性不同性別的人員組成。
第五條 醫(yī)學(xué)倫理審查委員會(huì)設(shè)主任委員一名,、副主任委員若干名,、委員若干名,、倫理委員會(huì)秘書若干名,并向當(dāng)?shù)厥称匪幤繁O(jiān)督管理局和相關(guān)部門備案,。每屆任期五年,,可以連任。
第六條 醫(yī)學(xué)倫理審查委員會(huì)隸屬于杭州市第三人民醫(yī)院,,獨(dú)立開展工作,,杭州市第三人民醫(yī)院為醫(yī)學(xué)倫理審查委員會(huì)提供充足的財(cái)政支持,保障培訓(xùn),、審查和咨詢等,。
第七條 醫(yī)學(xué)倫理審查委員會(huì)委員必須接受有關(guān)生物醫(yī)學(xué)研究的倫理道德和科學(xué)方面的培訓(xùn)與繼續(xù)教育。所有委員必須經(jīng)過GCP培訓(xùn),,并取得資格證書,。
第三章 職責(zé)
第八條醫(yī)學(xué)倫理審查委員會(huì)的工作必須遵守國家頒布的與藥物臨床試驗(yàn)、臨床研究,、實(shí)驗(yàn)研究以及動(dòng)物福利相關(guān)的法律法規(guī),,遵守世界醫(yī)學(xué)大會(huì)赫爾辛基宣言,即“公正,,尊重人格,,力求使受試者最大受益和盡可能避免傷害”。
第九條 醫(yī)學(xué)倫理審查委員會(huì)受理杭州市第三人民醫(yī)院需要進(jìn)行的倫理審查,。醫(yī)院倫理委員會(huì)負(fù)責(zé)項(xiàng)目開始前的倫理審查,,還應(yīng)對已通過審查、正在進(jìn)行的項(xiàng)目進(jìn)行倫理評價(jià)與審查,。
第十條醫(yī)學(xué)倫理審查委員會(huì)審查杭州市第三人民醫(yī)院藥物臨床試驗(yàn),、醫(yī)療技術(shù)、臨床應(yīng)用和科研活動(dòng)的倫理管理,,保證醫(yī)療質(zhì)量和醫(yī)療安全,,維護(hù)受試者的尊嚴(yán),、權(quán)利,、安全和福利。醫(yī)學(xué)倫理審查委員會(huì)可以根據(jù)審查項(xiàng)目專業(yè),,聘請倫理委員會(huì)獨(dú)立顧問,,就審查的項(xiàng)目向醫(yī)院倫理委員會(huì)提供專門的意見,但無表決權(quán),。這些獨(dú)立顧問可以是倫理或法律專家,、特定疾病或方法學(xué)專家,也可以是社區(qū),、病人或特定利益團(tuán)體的代表,。
第十一條醫(yī)學(xué)倫理審查委員會(huì)主任委員對倫理委員會(huì)工作負(fù)責(zé),;主持倫理委員會(huì)會(huì)議,對提交審查項(xiàng)目進(jìn)行審查,,審核簽署《倫理審查批件》和《倫理審查意見通知》等倫理審查決定文件,,對倫理委員會(huì)重大工作決定進(jìn)行審核,并批準(zhǔn)邀請獨(dú)立顧問,、加快審查,、免除審查、緊急會(huì)議審查,;現(xiàn)場監(jiān)督檢查,。
第十二條 醫(yī)學(xué)倫理審查委員會(huì)副主任委員在主任委員缺席時(shí)負(fù)責(zé)接替主任委員職責(zé),受主任委員委托處理倫理委員會(huì)相關(guān)事宜,。
第十三條 醫(yī)學(xué)倫理審查委員會(huì)秘書負(fù)責(zé)接收,、初審項(xiàng)目的申請材料,負(fù)責(zé)會(huì)議日程安排,、會(huì)議結(jié)果,、決議、通知,、檔案管理等日常工作,,并報(bào)告?zhèn)惱砦瘑T會(huì)主任委員。
第四章 工作程序
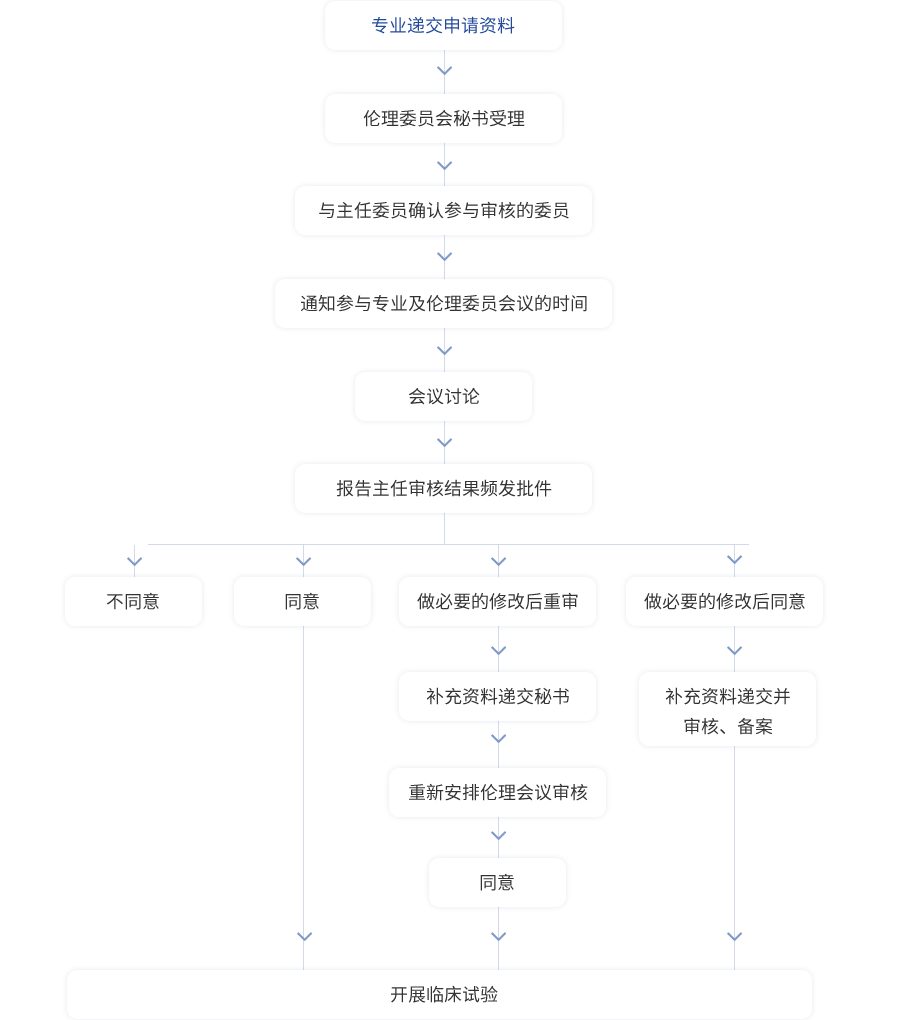
第十四條 醫(yī)學(xué)倫理審查委員會(huì)審查方式有會(huì)議審查,、緊急會(huì)議審查和簡易審查,,根據(jù)需要不定期召開會(huì)議。存在利益沖突的委員應(yīng)當(dāng)回避相關(guān)項(xiàng)目審查,。
第十五條
會(huì)議由主任委員或委托副主任委員主持,,醫(yī)學(xué)倫理審查委員會(huì)會(huì)議的到會(huì)法定人數(shù)必須超過半數(shù)成員,醫(yī)學(xué)倫理審查委員會(huì)對項(xiàng)目的審查意見應(yīng)在討論以后以投票的方式做出決定,,以超過委員半數(shù)以上的意見作為醫(yī)學(xué)倫理審查委員會(huì)審查決定,。
第十六條醫(yī)學(xué)倫理審查委員會(huì)依據(jù)審查決定簽發(fā)書面意見,并附出席會(huì)議的委員名單,、專業(yè)情況及本人簽名,。所有會(huì)議及決議均應(yīng)有書面記錄,項(xiàng)目資料和各項(xiàng)記錄由秘書保存至項(xiàng)目結(jié)束后五年,。
第十七條
醫(yī)學(xué)倫理審查委員會(huì)審查意見可以是: 批準(zhǔn),; 不批準(zhǔn); 修改后批準(zhǔn),; 修改后批準(zhǔn),; 終止或暫停研究。
GCP項(xiàng)目審查意見可以是: 同意; 作必要的修改后同意,; 不同意,; 終止或暫停已同意的研究。
第五章 受試者的權(quán)益保障
第十八條申請審查的項(xiàng)目須經(jīng)醫(yī)學(xué)倫理審查委員會(huì)審議同意并簽署批準(zhǔn)意見后方可實(shí)施,。涉及人體的研究在試驗(yàn)進(jìn)行期間,,試驗(yàn)方案的任何修改均應(yīng)經(jīng)醫(yī)學(xué)倫理審查委員會(huì)再次審查批準(zhǔn)。試驗(yàn)中發(fā)生任何嚴(yán)重不良事件,,應(yīng)及時(shí)報(bào)告醫(yī)學(xué)倫理審查委員會(huì),。
第十九條 醫(yī)學(xué)倫理審查委員會(huì)委員簽訂保密協(xié)議,各個(gè)項(xiàng)目資料和受試者信息按照《倫理審查保密管理制度》管理,。
第二十條 研究中發(fā)生的各種問題受試者可以向醫(yī)學(xué)倫理審查委員會(huì)投訴,,倫理秘書接待后協(xié)助解決,必要時(shí)向倫理主任匯報(bào),。
第六章 附則
第二十一條 杭州市第三人民醫(yī)院醫(yī)學(xué)倫理審查委員會(huì)有對本章程進(jìn)行解釋和修改的權(quán)利,。
第二十二條 本章程經(jīng)杭州市第三人民醫(yī)院醫(yī)學(xué)倫理審查委員會(huì)討論通過并生效。